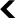Phagothérapie : des virus pour lutter contre les bactéries
- Bien avant le Covid-19, l’OMS mettait déjà en garde contre certains agents infectieux considérés comme « une des plus graves menaces pesant sur la santé mondiale » : ce sont les bactéries résistantes aux antibiotiques.
- Cette menace est responsable de 1,27 million de décès dans le monde en 2019, et est susceptible d’en causer 10 millions par an d’ici 2050.
- Un certain nombre de patients, infectés par des bactéries résistantes aux antibiotiques, ont déjà été sauvés par des bactériophages administrés à titre compassionnel.
- En France, le programme PHAGEinLYON a permis de traiter plusieurs dizaines de patients depuis 2017 et a récemment reçu un financement de l’ANR pour développer l’accès à la phagothérapie.
Alors que les principales causes de mortalité dans les pays développés, dont la France, sont les cancers et les maladies cardiovasculaires1, l’Organisation Mondiale de la Santé mettait en garde, bien avant le Covid-19, contre certains agents infectieux qu’elle considère comme « une des plus graves menaces pesant sur la santé mondiale, la sécurité alimentaire et le développement »2. Responsable de 1,27 million de décès dans le monde en 20193, susceptible d’en causer 10 millions par an d’ici 20504, cette menace, ce sont les bactéries résistantes aux antibiotiques.
Or, il est difficile de lutter contre ce phénomène. Limiter et optimiser l’usage des antibiotiques permet de diminuer l’apparition de nouvelles résistances. Mais la recherche de nouveaux antibiotiques est malheureusement peu fructueuse alors que nous avons aussi besoin de traitements capables de contrecarrer les résistances déjà en place… Et si LA bonne idée était encore plus ancienne que les antibiotiques ?
Soigner avec des virus
Décembre 1917. Félix d’Hérelle, un scientifique dont la biographie vaut le détour, publie une note dans les comptes-rendus de l’Académie des Sciences5. Il y décrit des microbes invisibles, capables de détruire les bactéries responsables de la dysenterie ou de la fièvre typhoïde en se multipliant à leurs dépens. Il qualifie ces microbes de « bactériophages » c’est-à-dire, littéralement, de mangeurs de bactéries. La virologie étant encore une discipline balbutiante à l’époque, Félix d’Hérelle n’en a pas conscience, mais il vient de décrire des virus capables d’infecter et de tuer des bactéries ! Aujourd’hui encore, on les appelle bactériophages, ou phages tout court.

La paternité de cette découverte est contestée, d’Hérelle n’étant pas le premier à réaliser ce genre d’observations. Il est en revanche le premier à avoir l’idée d’utiliser ces virus pour soigner. Sa note de 1917 explique déjà que les phages peuvent protéger des lapins contre la dysenterie, sans effet secondaire, et sont spécifiques de certaines souches de bactéries : les bases de la phagothérapie, le traitement par les phages, étaient posées.
En effet, puisqu’ils ne posent problème qu’aux bactéries, ces ennemis de nos ennemis ont le bon profil pour devenir nos alliés. La phagothérapie a ainsi suscité un engouement international dès les années 1920 ! À l’époque, il n’y avait pas d’autre moyen de lutter contre les infections bactériennes. La pénicilline a été découverte en 1928, mais elle n’a été purifiée et utilisée à des fins médicales qu’une douzaine d’années plus tard.
Des phages aux antibiotiques… et inversement ?
Les antibiotiques étaient peu chers, très efficaces, pratiques à produire, stocker et administrer. Dès les années 40, ils ont remplacé les bactériophages, dont l’efficacité semblait plus aléatoire, sans les faire disparaître : des phages thérapeutiques étaient disponibles en France jusqu’à la fin des années 80. Mais Alexander Flemming, découvreur de la pénicilline, avait raison d’alerter dès le départ sur les capacités de résistance des bactéries. Les phages pourraient-ils faire mieux que les antibiotiques sur ce point ?
Contrairement à ces molécules inertes, les virus évoluent spontanément pour s’adapter eux-mêmes aux adaptations des bactéries. Leur utilisation thérapeutique devrait reproduire la course à l’armement classiquement observée entre un parasite et son hôte au lieu d’aboutir au cul-de-sac dans lequel sont coincés les antibiotiques. Et d’autres raisons font des phages une alternative prometteuse !

Illustration : John Tenniel.
En termes de mécanismes d’actions, les antibiotiques peuvent être comparés à des bombes et les bactériophages à des tirs de précision : les premiers détruisent les bactéries en masse alors que les seconds sont spécifiques d’un type de bactérie. Au milieu du vingtième siècle, il était difficile de caractériser des souches bactériennes ou virales et le large champ d’action des antibiotiques était un avantage. Aujourd’hui, on sait que nos organismes sont de véritables écosystèmes, qui contiennent à peu près autant de bactéries que de cellules humaines6. Les bactériophages permettraient de cibler uniquement celles qui sont pathogènes, en préservant le reste de notre microbiote et en se concentrant spontanément au niveau des sites d’infection.
De la théorie à la pratique
Un certain nombre de patients, infectés par des bactéries résistantes aux antibiotiques, ont déjà été sauvés par des bactériophages administrés à titre compassionnel. Ces guérisons ont parfois un écho médiatique important, comme celle du conjoint de Steffanie Strathdee, épidémiologiste qui est depuis devenue co-directrice du premier centre de recherche en phagothérapie des États-Unis7.
En France, le programme PHAGEinLYON8 a permis de traiter plusieurs dizaines de patients depuis 2017 et a récemment reçu un financement de l’ANR pour développer l’accès à la phagothérapie. Ses résultats sont très prometteurs, mais on est encore loin de pouvoir déployer cette approche thérapeutique à large échelle.
Certaines contraintes techniques et administratives restent limitantes, à commencer par la production des phages médicaux, qui doit respecter de hauts standards de qualité. En France, il n’y a pour l’instant qu’une seule entreprise9 capable d’en produire pour des utilisations chez l’humain. La Belgique considère quant à elle les phages comme des préparations magistrales, pas des médicaments, ce qui facilite leur production. Dans tous les cas, la question de la brevetabilité de ces entités biologiques n’est pas nettement tranchée, ce qui peut freiner les investissements industriels. Et il reste des limites scientifiques au développement de la phagothérapie.
Répertorier les phages
Pour que la phagothérapie soit efficace, il faut identifier des virus qui correspondent aux besoins de chaque patient. Or, on ne sait pas prédire quel phage sera efficace contre une bactérie donnée. Pour le savoir, il faut faire des tests au cas par cas et espérer que les effets au sein de l’écosystème microbien du patient seront identiques à ceux observés in vitro. En général, les patients sont traités avec des cocktails de plusieurs phages potentiellement efficaces.
Pour cibler un maximum de bactéries, on a ainsi besoin de larges répertoires de phages dans lesquels piocher. Et si la diversité naturelle des phages est énorme, estimée à 108 espèces10, nous sommes loin d’en avoir catalogué assez pour pouvoir généraliser la phagothérapie. Pourtant, certaines structures y travaillent depuis des décennies : les pays du bloc soviétique n’ayant pas eu accès aux antibiotiques pendant la guerre froide, leur utilisation des phages est particulièrement développée (ce qui génère d’ailleurs du tourisme médical).
Par ailleurs, il faut évaluer correctement l’efficacité de la phagothérapie au-delà des cas compassionnels. Quelques essais cliniques standards ont été réalisés depuis 2010, contre des infections pour lesquelles les cocktails de phages peuvent être standardisés façon « prêt-à-porter ». Certains sont prometteurs11, mais cette méthodologie d’évaluation est moins adaptée aux usages « sur mesure » des bactériophages.
Enfin, même si elle ne concerne que certains patients, une caractéristique des phages reste limitante : quelques zones du corps leur sont inaccessibles, comme le système nerveux central ou l’intérieur de nos cellules.
Un traitement en devenir
Malgré ses promesses, la phagothérapie n’est donc pas (encore) une révolution thérapeutique. Mais cette nouvelle approche est à penser en combinaison avec les outils déjà à notre disposition ! Des synergies intéressantes ont par exemple été observées avec des antibiotiques.
On envisage aussi d’utiliser certaines protéines produites par les bactériophages, notamment les lysines, des enzymes capables de dégrader les parois bactériennes et les biofilms, comme des outils thérapeutiques à part entière. Ou de modifier génétiquement des phages pour cibler des bactéries réfractaires.
Difficile de prédire la façon dont les bactériophages changeront notre réponse aux infections bactériennes, mais ils semblent pouvoir répondre à certains de nos besoins actuels et il y a des chances pour qu’on entende de plus en plus souvent parler d’eux12 !
Pour aller plus loin
Événement en lien avec cet article : colloque sur l’antibiorésistance organisé par l’Inserm et l’Institut Pasteur, le 7 juin : https://www.pasteur.fr/fr/journal-recherche/evenements/colloque-scientifique-antibioresistance-amr