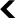Comment les perturbateurs endocriniens dérèglent le développement du cerveau
- Au cours de la deuxième semaine après la naissance, un pic d'hormones est sécrété par les neurones GnRH dans un phénomène appelé "mini-puberté".
- Ce phénomène semble signaler à l'organisme que la naissance s'est bien passée et qu'il peut continuer à développer des organes reproducteurs et un cerveau.
- Les perturbateurs endocriniens – des produits chimiques très souvent présents dans les plastiques qui ressemblent aux molécules du système hormonal – peuvent affecter ce processus. Nous sommes tous exposés à ces molécules, à des doses variables.
- De faibles concentrations de perturbateurs endocriniens à des moments clés comme la "mini puberté" peuvent affecter ces processus naturels en retardant le développement de l'appareil reproducteur et du cerveau de l'enfant.
- Vincent Prevot a pour objectif d'étudier l'exposition des enfants pendant les 1 000 premiers jours de leur vie et d'aider les familles à limiter la présence de substances toxiques dans leur environnement.
En perturbant l’interaction entre des neurones et leurs astrocytes, les molécules dérivées de la pétrochimie exerçant une activité endocrine perturbent à la fois la fonction reproductrice et le développement du cerveau.
Le cerveau est composé de deux principales familles de cellules : les neurones, qui réalisent l’activité cérébrale proprement dite, et les cellules gliales, notamment les astrocytes, qui modulent le fonctionnement des premiers. Cette régulation est essentielle au cours du développement, mais elle peut être altérée par des polluants, comme les perturbateurs endocriniens qui ont envahi notre environnement.
Tout se joue au niveau de l’hypothalamus. Cette structure, située au cœur du cerveau, à l’interface entre le cortex et la moelle épinière commande la sécrétion des hormones gonadotropes, LH et FSH, qui assurent, au cours du développement, la croissance des gonades, les organes qui produisent les gamètes.
Une fois formées, celles-ci vont sécréter des hormones stéroïdiennes, qui sont à leur tour détectées par l’hypothalamus. Grâce à cette boucle, le cerveau est ainsi informé sur l’état de maturité du système reproducteur des mammifères. Après la puberté, cette boucle régule le cycle menstruel chez la femme et la production de spermatozoïdes chez l’homme.
Des neurones spéciaux
Ce système repose sur une poignée de neurones dans le cerveau – on en compte seulement 2 000 chez l’humain et 800 chez la souris – qui libèrent la Gonadotrophin Releasing Hormone (GnRH). Ils sont particuliers dès leur naissance : ils ne se forment pas dans le cerveau mais dans le nez. Ils migrent ensuite au cours de la vie fœtale vers l’hypothalamus. Spéciaux encore par leur organisation : contrairement à la plupart des neurones spécialisés, ils ne constituent pas de noyaux. Ils se disséminent entre le bulbe olfactif et l’hypothalamus. Spéciaux toujours parce que, malgré cette organisation non conventionnelle, ils se coordonnent pour contrôler la sécrétion des hormones gonadotropes.
Les neurones à GnRH ne travaillent pas seuls. Ils s’associent à d’autres neurones, qui captent les informations du reste du corps et du monde extérieur. En cas de besoin, ils peuvent ainsi mettre la fonction reproductive en veille, afin de ne pas gaspiller de précieuses ressources à un moment défavorable à la procréation.
Les cellules gliales assurent la création et l’entretien des connexions synaptiques entre les neurones. Un rôle crucial mais fragile qui franchit un cap critique dès la deuxième semaine après la naissance. A ce moment-là, les neurones à GnRH sécrètent un pic d’hormones. On nomme ce phénomène « mini puberté ». Il semble signaler que la naissance s’est bien déroulée et que le corps peut poursuivre la croissance des organes reproducteurs et du cerveau en général. Au niveau de l’hypothalamus, c’est le moment où les astrocytes se collent aux neurones à GnRH pour y rester toute leur vie.
Une association cruciale
Cette mini puberté peut être perturbée par une naissance prématurée, expliquant peut-être la vulnérabilité aux maladies non transmissibles des enfants nés trop tôt, comme les troubles de l’apprentissage ou du métabolisme. Elle est aussi sensible à l’environnement chimique. Une famille de molécules chimiques inquiète tout particulièrement : les perturbateurs endocriniens – de composés très souvent présents dans les matières plastiques qui ressemblent à des molécules du système hormonal. Ils altèrent ainsi la communication entre les organes, par exemple en se faisant passer pour une hormone sexuelle ou en bloquant la liaison de celle-ci avec son récepteur.
Chez le rat, des études ont montré que l’exposition aux perturbateurs endocriniens empêche l’association entre astrocytes et neurones à GnRH. Cela se traduit par un retard de la puberté et des problèmes de fertilité chez l’adulte, sans que le fonctionnement des neurones à GnRH seuls ne semble altéré.
Qu’en est-il chez l’humain ? C’est une question à laquelle nous essayons de répondre grâce au projet de la fédération hospitalo-universitaire « 1 000 jours pour la santé : prendre soin avant de soigner », menée par les universités de Lille et d’Amiens, l’Inserm, l’Hôpital Jeanne de Flandre du CHU de Lille et coordonné par Laurent Storme. L’objectif est d’étudier l’exposition des enfants au cours des 1 000 premiers jours de leur vie et d’accompagner les familles pour limiter la présence de substances toxiques dans leur environnement.
D’autres études ont déjà révélé l’importance de l’environnement chimique sur les enfants, en particulier celles d’Anne-Simone Parent en Belgique. Avec son équipe, elle a montré que les enfants migrants, adoptés ou qui accompagnaient leurs parents, déclenchaient une puberté précoce lorsqu’ils s’installaient en Belgique vers l’âge de 5 ou 6 ans. Il semble que le changement d’exposition aux perturbateurs endocriniens, très présentes en Afrique et en Asie (principalement dans les pesticides), explique ce phénomène. Les perturbateurs bloquent la maturation reproductrice. Lorsque leur concentration baisse dans l’environnement des enfants, cette inhibition est levée et le cerveau initie une puberté complète.
En revanche, chez les enfants nés et vivant en Europe, ces produits semblent retarder la puberté. Leur action est complexe pour plusieurs raisons. D’une part, nous sommes tous exposés à différentes molécules, à des doses variables. C’est un cocktail chimique qu’il faut appréhender. D’autre part, par leur interaction avec le système hormonal, ils n’agissent pas de manière linéaire. Leur activité est décrite par une courbe en forme de U ou de U inversé. L’effet semble être maximale pour les concentrations faibles, surtout lors des fenêtres de vulnérabilité, comme la mini puberté.
Comme la nôtre, des études difficiles, tant à mener, dans un contexte où l’exposition est inévitable, qu’à interpréter, à cause de ces effets variables dans le temps et selon le cocktail, sont en cours. Elle ne se limitent pas à l’analyse des effets de cette pollution sur les fonctions reproductrices. Comme nous l’avons expliqué, la maturation du cerveau est intimement liée à la maturité des gonades. Les perturbateurs endocriniens sont ainsi les principaux suspects dans l’épidémie d’autisme observée aux États-Unis. Nous espérons que l’élucidation des mécanismes d’actions de ces polluants sur le cerveau et le développement en général aidera la société à mieux s’en protéger.
Propos recueillis par Agnès Vernet
Pour en savoir plus :
- GnRH neurons recruit astrocytes in infancy to facilitate network integration and sexual maturation. Pellegrino et al., Nature Neuroscience 2021. doi: 10.1038/s41593-021–00960‑z
- Cellular and molecular features of EDC exposure: consequences for the GnRH network. Lopez-Rodriguez et al. Nature Rewiews 2021. doi: 10.1038/s41574-020–00436‑3