Si un cancer arrive à se développer, c’est grâce à sa capacité de croître vite mais aussi parce qu’il manipule le système immunitaire : les tumeurs savent affaiblir la réponse immunitaire pour éviter son attaque. C’est pourquoi les médicaments qui ciblent et « réveillent » le système immunitaire – des immunothérapies, comme les anti-CTLA4, les anti-PD1 et les anti-PDL1, par exemple – se sont rapidement fait une place dans le traitement du cancer 1. Le résultat : davantage de rémissions durables. Et si les traitements contre les cancers ont beaucoup progressé grâce aux avancées en biologie, l’inverse est également vrai. La recherche fondamentale se nourrit aussi de la recherche clinique sur les immunothérapies.
Le réveil du système immunitaire
Les travaux du biophysicien Julien Husson, chercheur au Laboratoire d’hydrodynamique (LadHyX) de l’École polytechnique (CNRS-Institut Polytechnique de Paris), l’illustrent bien. « Mon but est de modéliser la manière dont la cellule tumorale et les cellules du système immunitaire interagissent », dit-il. Il cherche à comprendre un aspect à la fois fondamental et crucial de l’immunothérapie. Celui du réveil des lymphocytes T, des cellules du système immunitaire dont l’action est inhibée par le cancer. Autrement dit, il essaie de comprendre plus précisément « comment les immunothérapies bloquent l’effet immunosuppresseur des tumeurs et réactivent les lymphocytes T en utilisant des microbilles recouvertes d’anticorps qui miment des cellules tumorales et faire réagir les lymphocytes T ».
On sait que la clé de cette interaction est une protéine appelée PD-L1 exprimée à la surface des cellules tumorales. Elle se lie aux lymphocytes T qui s’approchent de la tumeur. Lorsqu’elle entre en contact avec le récepteur PD‑1 de ces cellules immunitaires, elle inhibe leur activité, comme un interrupteur. Les cellules T sont éteintes, incapables de diriger leurs armes vers la cellule anormale.
Les immunothérapies consistent à bloquer cette inhibition. On administre aux patients des anticorps antiPD-L1. Elles se lient spécifiquement à la protéine PD-L1 de la cellule tumorale et l’empêchent ainsi d’éteindre les lymphocytes T. L’inhibition de l’inhibition réveille le système immunitaire. Mais pour comprendre cela, il faut commencer par comprendre en détail comment la protéine PD-L1, à la surface de la tumeur, agit sur le lymphocyte T.
Observer les cellules de près
Julien Husson a donc collé des protéines PD-L1 sur des microbilles de la taille d’une cellule (quelques micromètres ou millièmes de millimètres). Elles constituent ainsi des modèles simplifiés des cellules tumorales. Puis, il filme la réaction d’une cellule immunitaire à l’aide d’un microscope optique. « On a découvert que lorsque les lymphocytes T entrent en contact avec une bille qui présente des anticorps activateurs, il produit d’énormes protrusions. » C’est un véritable baiser du lymphocyte dont Julien Husson est le premier à décrire les propriétés mécaniques (vous pouvez regarder la vidéo ci-dessous, ou ici) avec ses collègues du Centre de recherche de l’Institut Curie.
« Mais lorsque les billes présentent des protéines PD-L1 à leur surface, en plus des anticorps qui activent le lymphocyte T, les protrusions perdent de leur rigidité en comparaison avec un contact sans PD-L1», poursuit le spécialiste. Il observe des changements dans la formation de ces excroissances cellulaires, leur structure apparaît moins mobile au microscope. La rencontre avec les anticorps activateurs produit un remodelage du cytosquelette – l’ossature protéique du lymphocyte. Cette modification profonde de la cellule immunitaire lui permet de mobiliser son système cytotoxique pour attaquer la cellule anormale. Mais au contact de PD-L1, le remodelage semble différent et il fait l’hypothèse que c’est une des causes du blocage de l’activation immunitaire.
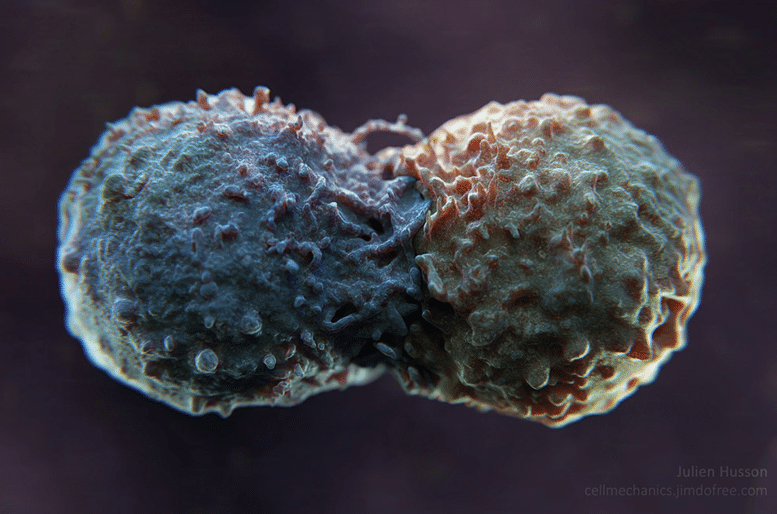
Pour confirmer cette hypothèse, Julien Husson et Olga Markova, chercheuse dans son équipe, s’apprêtent à reproduire ces expériences en remplaçant les microbilles par de véritables cellules de patients, grâce à une collaboration avec les équipes de Claire Hivroz et d’Emanuela Romano du Centre de recherche de l’Institut Curie dans le cadre d’un projet soutenu par la Fondation Bettencourt Schueller.
Ce travail pourrait aider les médecins à comprendre pourquoi certains patients ne répondent pas à l’immunothérapie. « Cette expérience implique des manipulations physiques extrêmement fines et répond à une problématique médicale », explique le chercheur de l’Institut Polytechnique de Paris. Elle s’inscrit dans une démarche de plus en plus pluridisciplinaire nourrie d’aller-retours entre la recherche clinique et la recherche fondamentale. « C’est une longue chaîne. Notre travail pourra peut-être servir dans quelques années à améliorer les stratégies thérapeutiques proposées aux patients », précise Julien Husson. Dans un premier temps, il éclaire le fonctionnement des lymphocytes T.
Pour en savoir plus
Cell, 2016;165(1):100–110. Basu R*, Whitlock BM*, Husson J*, Le Floc’h A, Jin W, Dotiwala F, Giannone G, Hivroz C, Lieberman J, Kam LC, and Huse M. (* co-first authors). Cytotoxic T cells use mechanical force to potentiate target cell killing.
Molecular Biology of the Cell, 2017; 28(23): 3229–3239. Micropipette Force Probe to quantify single-cell force generation: application to T cell activation. A. Sawicka, A. Babataheri, S. Dogniaux, A. I. Barakat, D. Gonzalez-Rodriguez, C. Hivroz, and J. Husson.
Biophysical Journal, March 16, 2021; DOI:https://doi.org/10.1016/j.bpj.2021.02.042. Rapid viscoelastic changes are a hallmark of early leukocyte activation. Alexandra Zak, Sara Violeta Merino-Cortés, Anaïs Sadoun, Farah Mustapha, Avin Babataheri, Stéphanie Dogniaux, Sophie Dupré-Crochet, Elodie Hudik, Hai-Tao He, Abdul I. Barakat, Yolanda R. Carrasco, Yannick Hamon, Pierre-Henri Puech, Claire Hivroz, Oliver Nüsse, Julien Husson.








